- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:40.
- Zadnja promjena 2025-06-01 07:36.
Ključna razlika između dušikovog monoksida i dušikovog pentoksida je u tome što je dušikov monoksid bezbojan plin dok je dušikov pentoksid bijela krutina.
Dušikov monoksid i dušikov pentoksid kemijski su spojevi koji sadrže dušik i kisik. To su dušikovi oksidi. Međutim, imaju različita kemijska i fizikalna svojstva.
Što je dušikov monoksid?
Dušikov monoksid je anorganski spoj kemijske formule NO. Zovemo ga dušikov oksid jer je dušikov oksid. To je zapravo slobodni radikal jer ima nespareni elektron. Štoviše, to je heteronuklearna dvoatomna molekula.
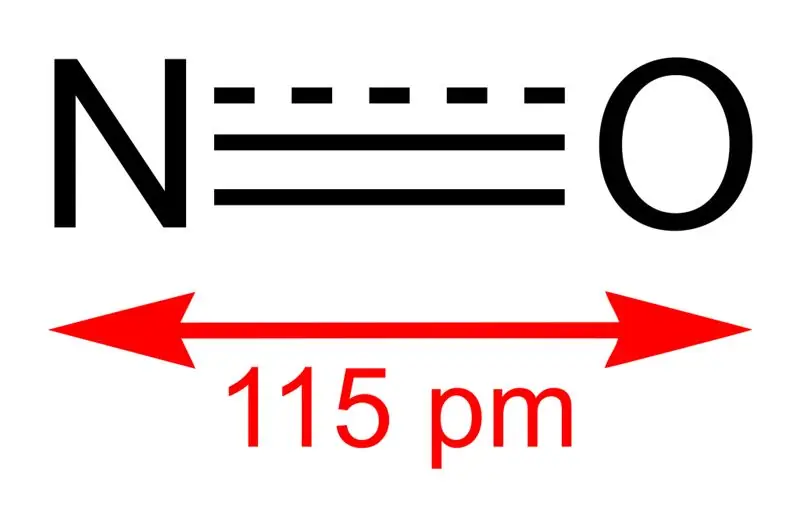
Slika 01: Struktura dušikovog monoksida i duljina veze između N i O
Molarna masa ovog spoja je 30 g/mol. Javlja se kao bezbojni plin. Osim toga, njegovo talište je -164 °C dok je vrelište -152 °C, što su vrlo male vrijednosti u usporedbi s onima drugih dušikovih oksida. Ovaj slobodni radikal možemo proizvesti oksidacijom amonijaka na 850 °C u prisutnosti platinastog katalizatora. Međutim, u laboratorijskim ga razmjerima možemo pripremiti redukcijom razrijeđene dušične kiseline s bakrom.
Što je dinitrogen pentoksid?
Dušikov pentoksid je anorganski spoj koji ima kemijsku formulu N2O5 Zovemo ga dušikov pentoksid. To je binarni dušikov oksid. Štoviše, nestabilan je i može djelovati kao opasni oksidans. Molarna masa spoja je 108,01 g/mol. Pojavljuje se kao krutina bijele boje.
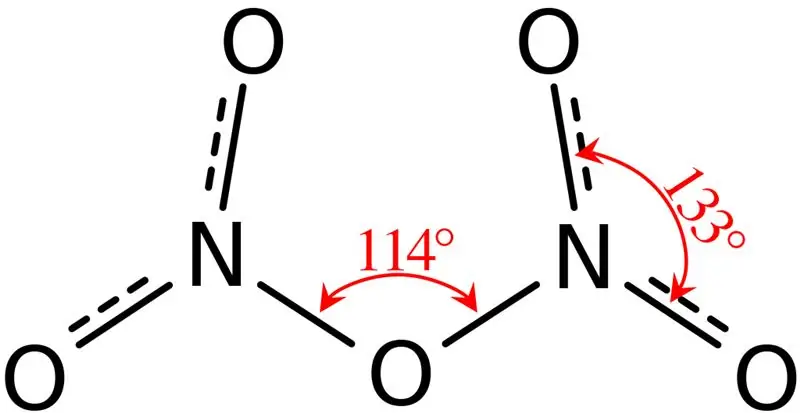
Slika 02: Struktura dinitrogen pentoksida
Nadalje, talište ovog spoja je 41 °C, a na 47 °C ovaj spoj podliježe sublimaciji. Ovaj spoj reagira s vodom, dajući dušičnu kiselinu. Osim toga, molekularni oblik molekule dušikovog pentoksida je ravan. Ovaj spoj možemo proizvesti dehidratacijom dušične kiseline s fosfornim pentoksidom.
Koja je razlika između dušikovog monoksida i dušikovog pentoksida?
Dušikov monoksid je anorganski spoj koji ima kemijsku formulu NO dok je dinitrogen pentoksid anorganski spoj koji ima kemijsku formulu N2O5 Ključna razlika između dušikovog monoksida i dušikovog pentoksida je u tome što je dušikov monoksid bezbojni plin, dok je dušikov pentoksid bijela krutina. Štoviše, možemo proizvesti dušikov monoksid oksidacijom amonijaka na 850 °C u prisutnosti platinastog katalizatora. Međutim, proizvodnja dušikovog pentoksida odvija se dehidracijom dušične kiseline s fosfornim pentoksidom. Kada se uzme u obzir molekularni oblik, dušikov monoksid je linearan dok je dušikov pentoksid ravan.
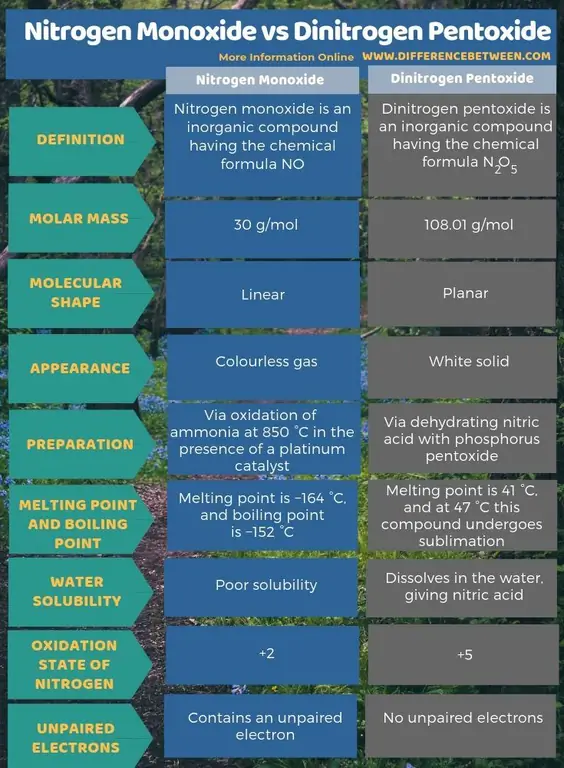
Sažetak - Dušikov monoksid protiv dinitrogen pentoksida
Dušikov monoksid je anorganski spoj koji ima kemijsku formulu NO dok je dinitrogen pentoksid anorganski spoj koji ima kemijsku formulu N2O5 Ključna razlika između dušikovog monoksida i dušikovog pentoksida je u tome što je dušikov monoksid bezbojan plin dok je dušikov pentoksid bijela krutina.






